Artículo de investigación
Study of in vitro fermentation kinetics of mixtures of forages from intensive silvopastoral systems (SSPI) with Leucaena leucocephala in Colombia
Estudio de la cinética fermentativa in vitro de mezclas de forrajes que incluyen Leucaena leucocephala proveniente de sistemas silvopastoriles intensivos (SSPi) en Colombia
Estudo in vitro da cinética fermentativa de misturas de forragens que incluem Leucaena leucocephala a partir de sistemas silvopastoris intensivos (SSPi) na Colômbia
Juan Fernando Naranjo1 Zoot, PhD;CvLAC, Omar Albeiro Ceballos2 Zoot, Xiomara Gaviria2 Zoot, MSc, Ariel Marcel Tarazona2 Zoot, MSc, PhD; CvLAC, Guillermo Antonio Correa3 Ing For, MSc, PhD; CvLAC, Julián David Chará4 MVZ, MSc, PhD; CvLAC Enrique Murgueitio4 MVZ; CvLAC, Rolando Barahona2 BSc, MSc, PhD; CvLAC
Fecha correspondencia:
Recibido: 13 de agosto de 2015.
Aceptado: 27 de junio de 2016.
Forma de citar:
Naranjo JF, Ceballos OA, Gaviria X, Tarazona AM, Correa GA, Chará JD, Murgueitio E, Barahona R. Estudio de la cinética fermentativa in vitro de mezclas de forrajes que incluyen Leucaena leucocephala proveniente de sistemas silvopastoriles intensivos (SSPi) en Colombia. Rev. CES Med. Zootec. 2016; Vol 11 (2): 6-17.
Open access
© Copyright
Creative commons
Éthics of publications
Peer review
Open Journal System
e-ISSN 1900-9607
Sobre los autores:
1Facultad de Medicina Veterinaria y Zootecnia de la Universidad CES. Grupo INCA-CES.
2 Universidad Nacional de Colombia, Facultad de Ciencias Agrarias, Departamento de Producción Animal.
3 Universidad Nacional de Colombia, Facultad de Ciencias Agrarias, Departamento de Ciencias Agronómicas.
4 Centro para la Investigación en Sistemas Sostenibles de Producción Agropecuaria, CIPAV.
Comparte
Abstract
A study of the in vitro fermentation dynamics of the forages star grass (Cynodon plectostachyus; E), Guinea grass (Megathyrsus maximus; G) and Leucaena leucocephala (L), available in intensive silvopastoral systems (ISS) was carried out. Samples of these forages were harvested in ISS set in tropical dry forest in the Valle del Cauca, Colombia. With these forages, ten mixes or different treatments were generated: E100, G100, L100, E33G66, E66G33, L33E66, L66E33, L33G66, L66G33 and L33E33G33. The shorter lag phase was observed with L100 (7.02 h) and E33G66 (7.11 h), lower (α= 0.05) than that of L33E66 (10.22 h) and G100 (9.85 h). The maximum production of gas (a) ranged between 97.34 and 253 ml/ g substrate for L100 and G100, respectively. The lowest HIP value was obtained with L100 (23.3 hours) and the gas accumulated to that point was 35.08 ml, which coincides with the lower value. The treatments that most accumulated gas were the grasses alone or their mixtures and those with the least accumulated gas included leucaena. Regarding FP, after 24 hours of incubation, the greater values occurred with L100 and mixtures that included leucaena. It is concluded that the inclusion of Leucaena was associated with decreases in the lag phase time and maximum gas production rates and with high values of FP, characteristics that may be associated with more efficient fermentation processes.
Keywords: forage legumes, gas production, leucaena, mixtures of forages.
Resumen
Se estudió la dinámica fermentativa in vitro de los forrajes pasto estrella (Cynodon plectostachyus; E), pasto guinea (Megathyrsus maximus; G) y leucaena (Leucaena leucocephala; L), disponibles en sistemas silvopastoriles intensivos (SSPi). Se recolectaron muestras en SSPi establecidos en bosque seco tropical en el Valle del Cauca, Colombia. Se realizaron 10 mezclas o tratamientos con diferentes porcentajes de inclusión: E100, G100, L100, E33G66, E66G33, L33E66, L66E33, L33G66, L66G33 y L33E33G33. El menor tiempo de fase Lag se observó con L100 (7,02 h) y E33G66 (7,11 h), menores (α = 0,05) a L33E66 (10,22 h) y G100 (9,85 h). Las producciones máximas de gas (a) variaron entre 97,34 y 253 ml/g sustrato para L100 y G100, respectivamente. El menor valor de HPI se obtuvo con L100 (23,3 horas) y el gas acumulado a ese punto fue 35,08 ml, que coincide con el valor más bajo. Los tratamientos de mayor acumulación de gas fueron los que incluyeron gramíneas solas o sus mezclas y los de menor acumulación de gas fueron los que incluyeron leucaena. En cuanto al FP, a las 24 horas de incubación los valores más altos se presentaron con L100 y en las mezclas que incluyeron leucaena. Se concluye que la inclusión de leucaena estuvo asociada a disminuciones en el tiempo de fase lag y tasas máximas de producción de gas, así como con altos valores de FP, características que pueden asociarse a mayor eficiencia en los procesos de fermentación.
Palabras clave: forrajes leguminosos, leucaena, mezclas de forrajes, producción de gas.
Resumo
Estudou-se a dinâmica fermentativa in vitro das forrageiras do capim estrela (Cynodon plectostachyus; E), capim colonião (Megathyrsus maximus; G) e leucaena (Leucaena leucocephala; L), disponíveis em sistemas silvopastoris intensivos (SSPi). Tomaram-se amostras em SSPi estabelecidos em bosque seco tropical no Vale do Cauca, Colômbia. Realizaram-se 10 misturas ou tratamentos com diferentes porcentagens de inclusão: E100, G100, L100, E33G66, E66G33, L33E66, L66E33, L33G66, L66G33 e L33E33G33. O menor tempo da fase Lag se observou com L100 (7,02 h) e E33G66 (7,11 h), menores (α = 0,05) a L33E66 (10,22 h) e G100 (9,85 h). As produções máximas de gás (a) variaram entre 97,34 e 253 ml/g substrato para L100 e G100, respectivamente. O menor valor de HPI obteve-se com L100 (23,3 horas) e o gás acumulado nesse ponto foi 35,08 ml, que coincide com o menor valor. Os tratamentos de maior acumulação de gás foram os que incluíram gramíneas solas ou suas misturas e os de menor acumulação de gás foram os que incluíram leucaena. Em quanto ao FP, as 24 horas de incubação os valores maiores apresentaram-se com L100 e em misturas que incluíram leucaena. Pode se concluir que a inclusão de leucaena esteve associada a diminuições no tempo de fase lag e taxas máximas de produção de gás, assim como com altos valores de FP, características que podem-se associar com a maior eficiência nos processos de fermentação.
Palavras-chave: forragens leguminosos, leucaena, misturas de forragens, produção de gás.
Introducción
Se reconoce que los forrajes tropicales típicos no logran cubrir los requerimientos nutricionales de los animales debido a que presentan altos contenidos de pared celular y bajos niveles de carbohidratos solubles (Juárez-Lagunes et al. 1999) además de sus bajos contenidos proteícos (Barahona y Sánchez, 2005). De otro lado, la composición química de los forrajes tropicales se ve fuertemente afectada por las condiciones ambientales y por la calidad de los suelos que son fundamentalmente deficientes en nitrógeno (Leng, 1990).
Una de las estrategias más promisorias para intensificar naturalmente la ganadería tropical y permitir que los agroecosistemas ganaderos puedan adaptarse y mitigar los efectos del cambio climático son los sistemas silvopastoriles intensivos (SSPi) con Leucaena leucocephala (Naranjo et al. 2012; Murgueitio et al. 2014). Estos sistemas producen más forraje: hasta 2 y 3 veces más que monocultivos de gramíneas tropicales (Molina et al. 2013; Cuartas et al. 2014; Gaviria et al. 2015b), y se comparan favorablemente contra cualquier concentrado comercial disponible en la región. Además, la leucaena también tiene bajos contenidos de fibra, con valores máximos de 42% de fibra en detergente neutro (FDN) y de 32% de fibra en detergente ácido (FDA) (Cuartas et al. 2014), favoreciendo mayor consumo de nutrientes, mejor digestibilidad de los alimentos y sin afectar las poblaciones microbianas en el rumen (Angarita et al. 2015) y con menores emisiones de metano entérico por kg de materia seca degradada (Molina et al. 2016).
En el trópico americano, las los pastos que crecen en SSPi con leucaena suelen tener una calidad nutricional superior a aquellos que crecen en praderas de monocultivos. El objetivo del presente estudio es contribuir al entendimiento de la dinámica fermentativa in vitro de forrajes presentes en SSPi en Colombia. Esta información es necesaria para elaborar planes de alimentación con base en las características de fermentación de estos forrajes.
Materiales y métodos
Forrajes evaluados, tratamientos
En este estudio se evaluaron tres forrajes: dos gramíneas típicas de los SSPi en Colombia: pasto estrella (Cynodon plectostachyus) y pasto guinea (Megathyrsus maximus) y el arbusto leguminoso Leucaena leucocephala. De cada forraje, se obtuvieron tres muestras, las cuales fueron obtenidas en un SSPi ubicado bajo condiciones de bosque seco tropical.
Se estudiaron 10 mezclas diferentes variando las proporciones de cada forraje en la mezcla como se indica en la tabla 1.
Procedencia de los forrajes evaluados
Los materiales evaluados provinieron de La Reserva Natural El Hatico localizada en Colombia a 3°27’ de latitud norte y 76°32’ de longitud oeste, en el municipio de El Cerrito (Valle del Cauca) con una altitud de 1.000 msnm, una pluviosidad promedio anual de 750 mm, distribuida en forma bimodal (marzo a mayo y octubre a noviembre); una humedad relativa de 75%, una temperatura promedio de 24 °C y una evaporación media de 1.825 mm por año (Tabla 2).
Experimento de producción de gas
Se utilizó la técnica in vitro descrita por Theodorou et al. (1994), incubando 0,5 g (500 mg) de muestra en botellas de vidrio de 110 ml. Se incluyeron seis horarios de retiro (6, 12, 24, 48, 72 y 96 horas), tres repeticiones y dos réplicas de los tratamientos evaluados. El inóculo utilizado procedió de una mezcla de líquido ruminal recolectado de varios animales cebú durante el proceso de faenado en un centro de beneficio en Medellín bajo estándares certificados de bienestar animal.
La presión de gas dentro de la botella se registró mediante punción a través del tapón de goma con una aguja hipodérmica acoplada a un manómetro Ashcroft® D1005PS Digital Pressure Gauge. Después de cada medición, se liberó el gas hasta igualar la presión externa e interna de las botellas.
Degradabilidad in vitro de la materia seca
La degradabilidad in vitro de la materia seca (DIVMS) se determinó en los residuos de la fermentación obtenidos en los seis horarios de retiro (6, 12, 24, 48, 72 y 96 horas) filtrando el contenido de cada botella a través de un crisol de vidrio con porosidad de 1 con la ayuda de una bomba de vacío. En cada uno de esos horarios se retiraron 3 botellas por tratamiento. El material filtrado fue secado a 65 ºC por 48 horas y la DIVMS se calculó como la diferencia entre el peso inicial y el peso de la MS recuperada en cada uno de los diferentes horarios. También se calculó factor de partición (FP como la relación de la DIVMS (mg) y la producción acumulada de gas (ml/g MO) en cada uno de los tiempos de retiro.
Análisis de la información y métodos estadísticos
El ajuste de las curvas de producción acumulativa de gas se realizó mediante procedimientos no lineales con la ayuda del programa CurveExpert Professional 2.0.0 (Hyams, 2013). El modelo utilizado fue una modificación de la expresión Gompertz (Lavrenčič et al. 1998):
Donde, Y= producción acumulada de gas a un tiempo x.
a > 0 es la producción máxima de gas.
b > 0 diferencia entre el gas inicial y el gas final a un tiempo x.
c > 0 tasa específica de acumulación de gas.
Se calcularon los siguientes indicadores de la fermentación: hora al punto de inflexión (HPI, horas), gas al punto de inflexión (GPI, ml), tasa máxima de producción de gas (TMPG, ml/h) y fase Lag (FL o establecimiento microbiano, h).
En su estimación se usaron las siguientes fórmulas:
Nota: El valor de e corresponde al número de Euler ≈ 2,718281828459
Los parámetros estimados en el modelo se analizaron utilizando el procedimiento para modelos lineales generales de SAS (2001). Para determinar el efecto de los tratamientos o mezclas de forrajes, se realizó un análisis de medidas repetidas en el tiempo con ayuda del procedimiento PROC MIXED de SAS (2001), donde los efectos fijos correspondieron al tratamiento y el tiempo (horarios), y el efecto aleatorio a la fuente de inóculo ruminal. La prueba de Tukey ajustada a un nivel de significancia α = 0.05 fue empleada para realizar la comparación de medias.
Resultados
Dinámica de la producción de gas in vitro
En la tabla 3 se presentan los parámetros de la cinética de producción de gas de los tratamientos evaluados. En este estudio, los tratamientos con menor tiempo de fase Lag corresponden a L100 (7,02 h) y E33G66 (7,11 h), siendo ambas menores (α = 0,05) a la fase lag observada con L33E66 (10,22 h) y G100 (9,85 h). La mayor fase Lag se observó con el tratamiento L33E66 (10,22 h).
Los volúmenes finales de producción de gas (Vol) se encontraron entre 97,34 y 253 ml para L100 y G100, menor y mayor respectivamente (α = 0,05). Al analizar el tiempo que tarda la curva de producción de gas en alcanzar su punto de inflexión (HPI) se observó que G100 fue el tratamiento o forraje que tardó más tiempo (31 h) en llegar a ese punto; mientras que el menor HPI fue para L100 (23,3 horas; α = 0,05). Por su parte, la cantidad de gas acumulada al momento de alcanzar el HPI fue consistente con lo observado para HPI, con G100 mostrando el mayor valor (93.08 ml) y L100 mostrando el valor más bajo (35,08 ml).
En la figura 1 se presentan las curvas de acumulación de gas de las diferentes mezclas de forraje estudiadas. Cabe anotar que a mayor inclusión de leucaena, menor fue la acumulación de gas de la mezcla. Esta relación negativa entre estas dos variables se demuestra en la regresión lineal y = -1.3952x + 236.67; R² = 0.8312, donde y = producción máxima de gas (Vol) mientras que x = porcentaje de inclusión de leucaena (de 0 a 100%) en la mezcla.
Degradación in vitro de la materia seca (DIVMS)
En la tabla 4 se presentan los resultados de degradación de MS. La inclusión de leucaena condujo a aumentos de la degradabilidad inicial de las mezclas. Así, los tratamientos con mayor proporción de leucaena (L100, L66G33, L66E33) presentaron las mayores DIVMS tanto a las 6 como a las 12 horas de incubación. Sin embargo, al final de la fermentación; la menor degradabilidad in vitro se observó en la presencia de leucaena o en las mezclas donde la inclusión de leucaena se encontraba en mayores proporciones.
En la tabla 5 se presentan los factores de partición de los tratamientos evaluados en los diferentes tiempos de fermentación. Los FP presentaron diferencias en los primeros tiempos de incubación (6, 12 y 24; α = 0,05) y los valores más altos se presentaron en L100 y en las mezclas que incluyeron leucaena en altas proporciones.
Discusión
Con respecto a la dinámica de la producción de gas in vitro puede sugerirse que la inclusión de leucaena en los tratamientos evaluados modifica los parámetros de la cinética de producción de gas. Rodríguez et al. (2010) observaron que la adición de TC extraídos de leguminosas tropicales, mejora los procesos de sincronía de energía y proteína en el rumen, favoreciendo la producción de proteína microbiana que puede pasar al duodeno. Las características químicas de los taninos condensados que posee la leucaena por su naturaleza pueden favorecer procesos fermentativos a nivel ruminal (Barahona et al. 2006).
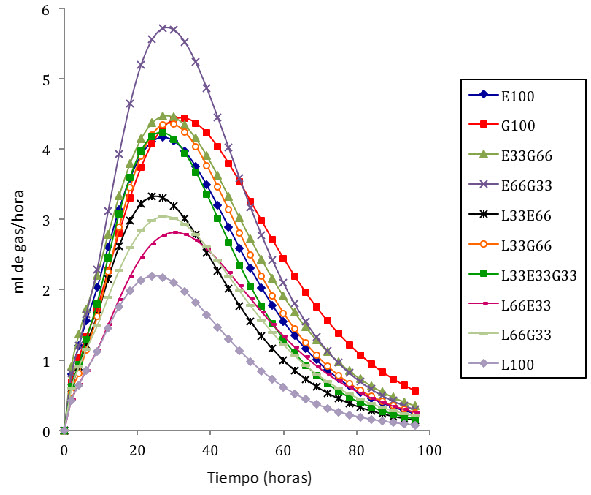
En la figura 2 se presenta el comportamiento en el tiempo de las tasas fraccionales de producción de gas de los tratamientos estudiados. No existen muchos reportes de tasas fraccionales de producción de gas de mezclas de forrajes tropicales. Sin embargo, los resultados de este estudio coinciden con reportes para leguminosas tropicales y pasturas incubadas solas, en los cuales las leguminosas muestran mejores resultados que las gramíneas (Fondevila et al. 2002, Mbugua et al. 2008, Rodríguez et al. 2009). Los ritmos fraccionales de producción de gas pueden estar asociados a rendimientos en la producción de proteína de origen microbiano. Existe una relación inversa entre la producción de gas y la de biomasa microbiana (Hungate 1966, Blümmel et al. 1997).
En la figura 2 se muestra cómo las gramíneas solas y asociadas entre sí (sin inclusión de leguminosa) tienen mayores tasas fraccionales de producción de gas, lo que podría estar indicando una ineficiencia en la fermentación al producirse más gas. En cambio, las mezclas que incluyen leucaena presentan menores tasas máximas, lo que pudiese estar indicando una mayor eficiencia en los procesos fermentativos (Blümmel et al. 1997). Además, se ha reportado que los alimentos ricos en precursores de ácido propiónico producen menos gas que aquellos ricos en precursores de los ácidos acético y butírico (Beever y Mould 2000). Por otra parte es importante resaltar que una producción importante de gas se produce cuando el sustrato se fermenta a acetato o butirato, mientras que la menor producción de gas se asocia con producción de propionato (Ngamsaeng et al. 2006).
Blümmel et al. (1999) recomendaron complementar la información de la cinética de producción de gas con información sobre la desaparición del sustrato degradado. Con respecto a la DIVMS es importante resaltar el efecto que tiene la inclusión de leucaena sobre la degradabilidad inicial de las mezclas. Así, los tratamientos que tienen más proporción de leucaena (L100, L66G33, L66E33) presentaron las mayores DIVMS sobre los demás tratamientos tanto a las 6 como a las 12 horas de incubación (α = 0, 05). Cabe anotar que la menor degradabilidad in vitro se observó en la presencia de leucaena o en las mezclas donde la inclusión de leucaena era mayoritaria (α = 0, 05). Esto es similar a lo reportado por Cuartas et al. 2015, pero es diferente a lo reportado por Barahona et al. 2003, Gaviria et al. 2015a, Gaviria-Uribe et al. 2015 y Molina et al. 2013, quienes reportaron mayores degradabilidades con leucaena (alrededor del 60%), siendo incluso mayores a las de las gramíneas acompañantes.
El factor de partición ha sido considerado como un indicador de la eficiencia de la fermentación porque parte del sustrato que se degrada se incorpora a rutas anabólicas para la síntesis de biomasa microbiana (Blümmel et al. 1994, Makkar 2000). En la tabla 5 se presentaron los factores de partición de los tratamientos evaluados en los diferentes tiempos de retiro. Los resultados encontrados son consistentes con otros estudios que han estudiado forrajes y mezclas de forrajes que incluyen metabolitos secundarios como los taninos, que contiene leucaena (Makkar et al. 1998 a,b). El FP disminuye a través del tiempo de incubación (Blümmel et al. 1999). En el presente estudio se refleja dicho comportamiento.
Los FP presentaron diferencias interesantes en los primeros tiempos de incubación (6, 12 y 24) y los valores más altos se presentaron en L100 y en las mezclas que incluyeron leucaena con relaciones tan altas como 21,09. Este es un comportamiento típico de forrajes ricos en taninos o con inclusión de extractos de taninos (Baba et al. 2002).
Los altos valores de FP sugieren mayor degradación. Estos resultados están relacionados también con los valores de DIVMS donde los tratamientos que presentaron mayores valores en los primeros tiempos de incubación fueron los tratamientos que incluyeron leucaena en la mezcla. Blümmel et al. (1997) sugirieron que resultados de este tipo pueden estar relacionados también con menores valores de producción de gas, mayor eficiencia en la síntesis de biomasa microbiana y por consiguiente una menor producción de metano; que estaría asociado a una mejor eficiencia en la fermentación.
Un elevado valor de FP indica mayor cantidad de sustrato degradado que se deriva hacia la síntesis de proteína microbiana Blümmel et al. (1997). Como se observa en la gráfica de las tasas máximas de producción de gas, los tratamientos que presentaron los valores más bajos fueron los tratamientos que incluyeron leucaena en la mezcla, es decir, podría afirmarse que esas tasas están asociadas con mayor eficiencia en la fermentación y consecuentemente a la formación de proteína microbiana y no a la producción de gas, que puede asociarse a pérdidas energéticas o ineficiencias en la fermentación.
Conclusiones
En este estudio, la inclusión de leucaena estuvo asociada a disminuciones en el tiempo de fase lag y en las tasas máximas de producción de gas, lo que pudiese estar asociado a una mayor eficiencia en los procesos de fermentación. Así mismo, los altos valores de FP encontrados con la inclusión de Leucaena sugieren mayor degradación, especialmente en los primeros tiempos de incubación.
Agradecimientos
Al Doctorado en Ciencias Animales de la Universidad de Antioquia y al programa Formación del Bicentenario mediante las Becas Doctorales “Francisco José de Caldas” de COLCIENCIAS. Agradecimientos especiales también la Reserva Natural El Hatico por permitir tomar las muestras de los forrajes aquí evaluados y a los grupos de Investigación GRICA de la Universidad de Antioquia y CIPAV.
Referencias
Angarita E, Molina I, Villegas G, Mayorga O, Chará J, Barahona R. 2015. Quantitative analysis of rumen microbial populations by qPCR in heifers fed on Leucaena leucocephala in the Colombian Tropical Dry Forest. Acta Scientiarum Anim Sci Maringá. 37(2):135-142. DOI: 10.4025/actascianimsci.v37i2.24836
Baba ASH, Castro FB, Ørskov ER. 2002. Partitioning of energy and degradability of browse plants in vitro and the implications of blocking the effects of tannin by the addition of polyethylene glycol. Anim Feed Sci Technol. 95: 93-104. DOI: http://dx.doi.org/10.1016/S0377-8401(01)00283-8
Barahona Rosales R, Sánchez Pinzon MS. 2005. Limitaciones físicas y químicas de la digestibilidad de pastos tropicales y estrategias para aumentarla. Rev CORPOICA - Ciencia Tecnol Agropec. 6(1):69–82. http://revista.corpoica.org.co/index.php/revista/article/view/39
Barahona R, Lascano CE, Narvaez N, Owen E, Morris P, Theodorou MK. In vitro degradability of mature and immature leaves of tropical forage legumes differing in condensed tannin and non-starch polysaccharide content and composition. J Sci Food Agric 2003; 83: 1256–1266. DOI: 10.1002/jsfa.1534
Barahona R, Sánchez S, Lascano CE, Owen E, Morris P, Theodorou MK. 2006. Effect of condensed tannins from tropical legumes on the activity of fibrolytic enzymes from the rumen fungus Neocallimastyx hurleyensis. Enz Microb Technol. 39(2):281–288. DOI:10.1016/j.enzmictec.2005.10.011
Beever DE, Mould FL. 2000. Forage Evaluation for Efficient Ruminant Livestock Production. En: Forage Evaluation in ruminant nutrition. CABI Publishing. Wallingford, UK. p. 15–42. http://www.cabi.org/bookshop/book/9780851993447
Blümmel M, Aiple KP, Steingass H, Becker K. 1999. A note on the stoichiometrical relationship of short chain fatty acid production and gas evolution in vitro in feedstuffs of widely differing quality. J Anim Physiol Anim Nutr. 81:157–167. DOI: 10.1046/j.1439-0396.1999.813205.x
Blümmel M, Steingass H, Becker K. 1994. The partitioning of in vitro fermentation products and its bearing for the prediction of voluntary feed intake. Proc Soc Nutr Physiol. 3:123–127.
Blümmel M, Steingass H, Becker K. 1997. The relationship between in vitro gas production, in vitro microbial biomass and N-15 incorporation and its implications for the prediction of voluntary feed intake of roughages. Br J Nutr. 77:911-921. DOI: http://dx.doi.org/10.1079/BJN19970089
Cuartas CA, Naranjo JF, Tarazona AM, Murgueitio E, Chará JD, Ku J, Solorio FJ, X Flores MX, Solorio B, Barahona R. 2014. Contribution of intensive silvopastoral systems to the adaptation and mitigation of climate change. Rev Colomb Cienc Pecu. 27:76-94. http://rccp.udea.edu.co/index.php/ojs/article/view/920
Cuartas-Cardona CA, Naranjo-Ramírez JF, Tarazona-Morales AM, Barahona-Rosales R, Rivera JE, Arenas F, Correa G. 2015. Cinética de fermentación in vitro de dietas de sistemas silvopastoriles intensivos. Rev Zoot Trop. 33(3): En prensa.
Fondevila M, Nogueira-Filho JC, Urdaneta AB. 2002. In vitro microbial fermentation and protein utilisation of tropical forage legumes grown during the dry season. Anim Feed Sci Technol. 95:1-14. DOI:10.1016/S0377-8401(01)00315-7
Gaviria X, Naranjo JF, Barahona R. 2015a. Cinética de fermentación in vitro de Leucaena leucocephala y Megathyrsus maximus y sus mezclas, con o sin suplementación energética. Pastos y Forrajes. 38(1):55-63. http://scielo.sld.cu/pdf/pyf/v38n1/pyf06115.pdf
Gaviria X, Rivera JE, Barahona R. 2015b. Calidad nutricional y fraccionamiento de carbohidratos y proteína en los componentes forrajeros de un sistema silvopastoril intensivo. Pastos y Forrajes. 38(2):194-201. http://payfo.ihatuey.cu/index.php/pasto/article/view/1838/2667
Gaviria-Uribe X, Naranjo-Ramirez JF, Bolivar-Vergara DM, Barahona-Rosales R. 2015. Consumo y digestibilidad en novillos cebuinos en un sistema silvopastoril intensivo. Arch Zoot, 64(245):21-27. http://www.uco.es/organiza/servicios/publica/az/az.htm
Hungate R. 1966. Rumen and its Microbes. Academic Press, New York, USA, 533 pp.
Hyams DG. 2013. CurveExpert Professional Documentation Release 2.0.0 195 p.
Juárez-Lagunes FI, Fox DG, Blake RW, Pell AN. 1999. Evaluation of tropical grasses for milk production by dual-purpose cows in tropical Mexico. J Dairy Sci. 82(10):2136-2145. DOI: http://dx.doi.org/10.3168/jds.S0022-0302(99)75457-3
Lavrenčič A, Mills CR, Stefanon B. 1998. Application of the Gompertz model to describe the fermentation characteristics of chemical components in forages. Anim Sci. 66:155-161. DOI: 10.1017/S1357729800008924
Leng RA. 1990. Factors affecting the utilization of “poor-quality” forages by ruminants particularly under tropical conditions. Nutr Res Reviews. 3(1):277–303. DOI: http://dx.doi.org/10.1079/NRR19900016
Makkar HPS. 2000. Applications of the in vitro gas method in the evaluation of feed resources, and enhancement of nutritional value of tannin-rich tree/browse leaves and agro-industrial by-products. Proceedings Meeting IAEA Technical Cooperation Regional AFRA Project. Cairo, Egypt, pp. 23- 40.
Makkar HPS, Blümmel M, Becker K. 1998a. Application of an in vitro gas method to understand the effects of natural plant products on availability and partitioning of nutrients. En: ER Deaville, E Owen, AT Adesogan, C Rymer, JA Huntington, TLJ Lawrence (Eds.) In Vitro Techniques for Measuring Nutrient Supply to Ruminants, BSAS Occasional Publication No. 22:147- 150.
Makkar HPS, Sen S, Blümmel M, Becker K. 1998b. Effects of fractions containing saponins from Yucca schidigera, Quillaja saponaria and Acacia auriculoformis on rumen fermentation. J Agric Food Chem. 46:4324- 4328. DOI: 10.1021/jf980269q
Mbugua DM, Kiruiro EM, Pell AN. 2008. In vitro fermentation of intact and fractionated tropical herbaceous and tree legumes containing tannins and alkaloids. Anim Feed Sci Technol. 146:1–20. DOI:10.1016/j.anifeedsci.2007.11.008
Molina IC, Angarita EA, Mayorga OL, Chará J, Barahona-Rosales, R. 2016. Effect of Leucaena leucocephala on methane production of Lucerna heifers fed a diet based on Cynodon plectostachyus. Livest Sci. 185:24-29.
http://dx.doi.org/10.1016/j.livsci.2016.01.009.
Molina IC, Cantet JM, Montoya S, Correa GA, Barahona R. 2013. Producción de metano in vitro de dos gramíneas tropicales solas y mezcladas con Leucaena leucocephala o Gliricidia sepium. Rev CES Med Vet Zoot. 8: 15-31. http://revistas.ces.edu.co/index.php/mvz/article/view/2677
Murgueitio Restrepo E, Chará Orozco JD, Barahona Rosales R, Cuartas Cardona CA, Naranjo Ramírez JF. 2014. Intensive silvopastoral systems (ISPS). Mitigation and adaptation tool to climate change. Trop Subtrop Agroecosyst. 17(3) 501-507. http://www.veterinaria.uady.mx/ojs/index.php/TSA/article/view/1558
Naranjo JF, Cuartas CA, Murgueitio ER, Chará JD, Barahona R. 2012. Balance de gases de efecto invernadero en sistemas silvopastoriles intensivos con Leucaena leucocephala en Colombia. Livest Res Rural Dev. 24 (8):150. http://www.lrrd.org/lrrd24/8/nara24150.htm
Ngamsaeng A, Wanapat M, Khampa S. 2006. Evaluation of local tropical plants by in vitro rumen fermentation and their effects on fermentation end-products. Pakistan J Nutr. 5: 414–418. http://www.pjbs.org/pjnonline/ab525.htm
Rodríguez R, Fondevila M, Castrillo C. 2009. In vitro ruminal fermentation of Pennisetum purpureum CT-115 supplemented with four tropical browse legume species. Anim Feed Sci Technol. 151: 65–74. DOI:10.1016/j.anifeedsci.2008.11.005
Rodríguez R, Mota M, Castrillo C, Fondevila M. 2010. In vitro rumen fermentation of the tropical grass Pennisetum purpureum and mixtures with browse legumes: effects of tannin contents. J Anim Phys Anim Nutr. 94:696-705. DOI: 10.1111/j.1439-0396.2010.01001.x
SAS. 2001. SAS/STAT: Guide for personal computer. Versión 8.2. SAS Inst., Cary, NY, USA.
Theodorou MK, Williams BA, Dhanoa MS, McAllan ADB, France JA. 1994. Simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds. Anim Feed Sci Technol. 48:185–197. DOI: 10.1016/0377-8401(94)90171-6.
Tabla 2. Composición química de los tratamientos o mezclas de forrajes evaluadas (g/kg).
|
Fracción |
E100 |
G100 |
E33G66 |
E66G33 |
L33E33G33 |
L33E66 |
L33G66 |
L66E33 |
L66G33 |
L100 |
|
PC |
86 |
101 |
95 |
90 |
146 |
141 |
151 |
197 |
202 |
256 |
|
FDN |
691 |
668 |
669 |
680 |
553 |
546 |
546 |
430 |
443 |
318 |
|
FDA |
271 |
354 |
350 |
351 |
323 |
323 |
323 |
296 |
412 |
270 |
|
(E) pasto estrella (Cynodon plectostachyus), (G) pasto guinea (Megathyrsus maximus) y (L) arbusto leguminoso Leucaena leucocephala. E100: 100% Leucaena; G100: 100% Guinea; E33G66: 33% Estrella 66% Guinea; E66G33: 66% Estrella 33% Guinea; L33E33G33: 33% Leucaena 33% Estrella 33% Guinea; L33E66: 33% Leucaena 66% Estrella; L33G66: 33% Leucaena 66% Guinea; L66E33: 66% Leucaena, 33% Estrella; L66G33: 66% Leucaena 33% Guinea; L100: 100% Leucaena. |
||||||||||
Tabla 1. Proporción de estrella, guinea y leucaena en las mezclas forrajeras evaluadas en el experimento.
|
Mezcla o Tratamiento |
Leucaena % |
Estrella % |
% Guinea |
|
E100 |
0 |
100 |
0 |
|
G100 |
0 |
0 |
100 |
|
E33G66 |
0 |
33 |
66 |
|
E66G33 |
0 |
66 |
33 |
|
L33E33G33 |
33 |
33 |
33 |
|
L33E66 |
33 |
66 |
0 |
|
L33G66 |
33 |
0 |
66 |
|
L66E33 |
66 |
33 |
0 |
|
L66G33 |
66 |
0 |
33 |
|
L100 |
100 |
0 |
0 |
|
(E) pasto estrella (Cynodon plectostachyus), (G) pasto guinea (Megathyrsus maximus) y (L) arbusto leguminoso Leucaena leucocephala. E100: 100% Leucaena; G100: 100% Guinea; E33G66: 33% Estrella 66% Guinea; E66G33: 66% Estrella 33% Guinea; L33E33G33: 33% Leucaena 33% Estrella 33% Guinea; L33E66: 33% Leucaena 66% Estrella; L33G66: 33% Leucaena 66% Guinea; L66E33: 66% Leucaena, 33% Estrella; L66G33: 66% Leucaena 33% Guinea; L100: 100% Leucaena. |
|||
Tabla 3. Parámetros de la cinética de producción de gas estimados de acuerdo al modelo Gompertz modificado.
|
|
E100 |
E33G66 |
L66G33 |
L33E33G33 |
E66G33 |
L100 |
L33E66 |
G100 |
L33G66 |
L66E33 |
|
Vol |
204,3bcd |
234,5abc |
154,1de |
187,2cd |
269,0a |
97,34e |
150,3de |
253,0ab |
206,3abcd |
148,8de |
|
FL |
7,77abc |
7,11c |
7,47bc |
8,77abc |
9,33abc |
7,02c |
10,22a |
9,85ab |
9,61abc |
7,6abc |
|
HPI |
25,67abc |
26,71abc |
26,09abc |
24,94bc |
26,58abc |
23,3c |
24,17bc |
31,07a |
27,59abc |
28,98ab |
|
GPI |
75,18bcd |
86,28abc |
56,69de |
68,87cd |
98,96a |
35,8e |
55,3de |
93,08ab |
75,89abcd |
54,77de |
|
TMPG |
4,18ab |
4,48ab |
3,04bc |
4,25ab |
5,75a |
2,2c |
3,36bc |
4,46ab |
4,41ab |
2,83bc |
|
(E) pasto estrella (Cynodon plectostachyus). (G) pasto guinea (Megathyrsus maximus) y (L) arbusto leguminoso Leucaena leucocephala. E100: 100% Leucaena; G100: 100% Guinea; E33G66: 33% Estrella 66% Guinea; E66G33: 66% Estrella 33% Guinea; L33E33G33: 33% Leucaena 33% Estrella 33% Guinea; L33E66: 33% Leucaena 66% Estrella; L33G66: 33% Leucaena 66% Guinea; L66E33: 66% Leucaena, 33% Estrella; L66G33: 66% Leucaena 33% Guinea; L100: 100% Leucaena. Vol: Volumen final de gas (ml), HPI: hora al punto de inflexión (horas), GPI: gas al punto de inflexión (ml), TMPG: tasa máxima de producción de gas (ml/h), FL: Lag (horas). Letras distintas en la misma fila indican diferencias significativas (α = 0,05). |
||||||||||
Figura 1. Curvas modeladas de producción de gas acumulado de los tratamientos evaluados.
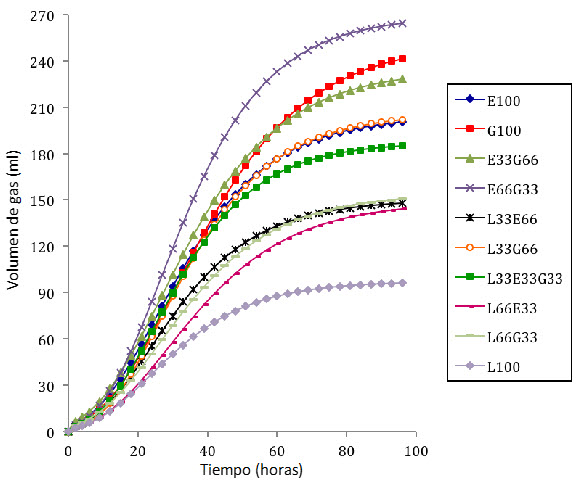
Tabla 4. Degradabilidad ruminal in vitro en diferentes tiempos de incubación (g/g ms incubada).
|
Tiempo |
E100 |
E33G66 |
L66G33 |
L33E33G33 |
E66G33 |
L100 |
L33E66 |
G100 |
L33G66 |
L66E33 |
|
6 |
0,17b |
0,12d |
0,23a |
0,16bc |
0,13cd |
0,25a |
0,18b |
0,15c |
0,18b |
0,20ab |
|
12 |
0,16b |
0,15b |
0,23a |
0,22a |
0,16b |
0,23a |
0,18ab |
0,18ab |
0,21ab |
0,19ab |
|
24 |
0,32a |
0,32a |
0,32a |
0,27a |
0,33a |
0,31a |
0,30a |
0,31a |
0,32a |
0,27a |
|
48 |
0,51a |
0,52a |
0,41b |
0,45b |
0,53a |
0,39c |
0,45b |
0,52a |
0,48ab |
0,41bc |
|
72 |
0,49ab |
0,59ab |
0,39bc |
0,50b |
0,59a |
0,34d |
0,44b |
0,60a |
0,54ab |
0,43cd |
|
96 |
0,57ab |
0,59ab |
0,46cd |
0,50c |
0,59ab |
0,40d |
0,47c |
0,60a |
0,54abc |
0,44c |
|
(E) pasto estrella (Cynodon plectostachyus). (G) pasto guinea (Megathyrsus maximus) y (L) arbusto leguminoso Leucaena leucocephala. E100: 100% Leucaena; G100: 100% Guinea; E33G66: 33% Estrella 66% Guinea; E66G33: 66% Estrella 33% Guinea; L33E33G33: 33% Leucaena 33% Estrella 33% Guinea; L33E66: 33% Leucaena 66% Estrella; L33G66: 33% Leucaena 66% Guinea; L66E33: 66% Leucaena, 33% Estrella; L66G33: 66% Leucaena 33% Guinea; L100: 100% Leucaena. Letras distintas en una misma fila indican diferencia estadísticamente significativa entre tratamientos (α = 0.05). |
||||||||||
Tabla 5. Factor de partición (FP) (relación de la cantidad de sustrato degradado (mg) y el volumen de gas producido (ml) durante el proceso de fermentación).
|
Tiempo |
E100 |
E33G66 |
L66G33 |
L33E33G33 |
E66G33 |
L100 |
L33E66 |
G100 |
L33G66 |
L66E33 |
|
6 |
7,36e |
4,52f |
12,71c |
9,91d |
6,05e |
21,09a |
10,93d |
7,06e |
12,62c |
16,50b |
|
12 |
3,22d |
2,66d |
5,79b |
4,82c |
2,76d |
8,18a |
4,49c |
3,78c |
5,44bc |
6,58b |
|
24 |
2,22b |
2,09b |
2,88ab |
1,84b |
1,77b |
3,75a |
2,48b |
2,22b |
2,4b |
2,99ab |
|
48 |
1,56a |
1,48a |
1,67a |
1,41a |
1,19a |
2,27a |
1,75a |
1,49a |
1,45a |
1,83a |
|
72 |
1.40a |
1,31a |
1,47a |
1,28a |
1,07a |
2,00a |
152a |
1,25a |
1,28a |
1,44a |
|
96 |
1,14a |
1,23a |
1,18a |
1,21a |
1,00a |
1,62a |
1,35a |
1,13a |
1,22a |
1,40a |
|
(E) pasto estrella (Cynodon plectostachyus). (G) pasto guinea (Megathyrsus maximus) y (L) arbusto leguminoso Leucaena leucocephala. E100: 100% Leucaena; G100: 100% Guinea; E33G66: 33% Estrella 66% Guinea; E66G33: 66% Estrella 33% Guinea; L33E33G33: 33% Leucaena 33% Estrella 33% Guinea; L33E66: 33% Leucaena 66% Estrella; L33G66: 33% Leucaena 66% Guinea; L66E33: 66% Leucaena, 33% Estrella; L66G33: 66% Leucaena 33% Guinea; L100: 100% Leucaena. Letras distintas en una misma fila indican diferencia estadísticamente significativa entre tratamientos (α = 0,05). |
||||||||||
Figura 2. Tasa fraccional de producción de gas de los tratamientos evaluados.